Gás ideal: quando valem as equações que conhecemos?
29 de novembro, 2013 às 8:32 | Postado em Questões do ENEM, vestibulares, concursos, Teoria Cinética dos Gases, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Professor, desculpe incomodar. mas gostaria de saber sua opinião sobre está questão. estou fazendo física 2 e cheguei ao primeiro resultado.
http://einsteinmania.com/aprofundamento/questao-25-ita-2010-polemica/
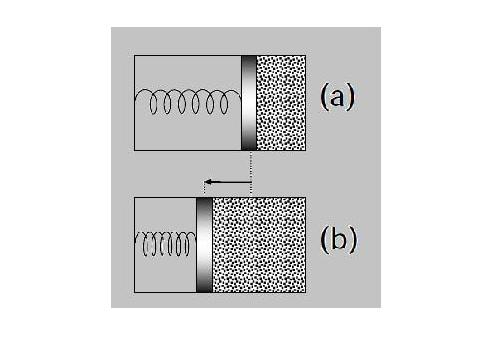
(Questão 25 – ITA 2010) Uma parte de um cilindro está preenchida com um mol de um gás ideal monoatômico a uma pressão P0 e temperatura T0. Um êmbolo de massa desprezível separa o gás da outra seção do cilindro, na qual há vácuo e uma mola em seu comprimento natural presa ao êmbolo e à parede oposta do cilindro, como mostra a figura.
O sistema está termicamente isolado e o êmbolo, inicialmente fixo, é então solto, deslocando-se vagarosamente até passar pela posição de equilíbrio, em que a sua aceleração é nula e o volume ocupado pelo gás é o dobro original, conforme mostra a figura.
Desprezando os atritos, determine a temperatura do gás na posição de equilíbrio em função da sua temperatura inicial.
Desde já agradeço.
Como deveria ser bem sabido TODAS as equações que conhecemos sobre os Gases Ideias tem como pressuposto que a amostra gasosa esteja em EQUILÍBRIO TERMODINÂMICO (ET). É somente na condição de ET que as VARIÁVEIS DE ESTADO (pressão, temperatura, …) estão definidas.
Fora do ET as variáveis de estado inexistem! Por exemplo, imaginemos um gás contido em um recipiente cilíndrico que possui uma parede móvel (êmbolo) e que inicialmente esteja em ET. Quando o êmbolo for movido, não mais existe UMA ÚNICA pressão valendo ao longo de todo o volume da amostra. Se o êmbolo se afasta da sua posição original, aumentando o volume do cilindro, junto ao êmbolo se produz uma rarefação do gás que se propaga então através de toda a amostra e durante este processo NÃO HÁ um única pressão valendo ao longo de todo o espaço interno ao cilindro. Idem para as demais VARIÁVEIS DE ESTADO.
Conforme está explícito no nome da EQUAÇÃO GERAL DE ESTADO DO GÁS IDEAL (Equação de Clapeyron), a aplicabilidade da equação se restringe rigorosamente a que amostra gasosa se encontre em ET! A equação NÃO vale fora do ET simplesmente porque as variáveis de estado inexistem.
Quando imaginamos um processo através do qual um sistema gasoso passa de um ET a outro, somente podemos equacionar o processo, usando a Equação de Clapeyron (ou outras equações como as famosas expressões que envolvem pressão, volume e temperatura em uma transformação adiabática) se supusermos que o processo seja um PROCESSO QUASE-ESTÁTICO (PQE), isto é, um processo muitíssimo lento ao longo do qual a amostra evolua sempre em ET. A transformação sofrida pelo gás é dita então TRANSFORMAÇÃO REVERSÍVEL.
Processos reais não são PQE. E quando um processo não é um PQE estamos tratando de uma TRANSFORMAÇÃO IRREVERSÍVEL ao longo da qual as equações de estado NÃO VALEM.
Passo agora à discussão da questão.
Para que o êmbolo se desloque muito lentamente (portanto para que a transformação acontecida na amostra gasosa seja um PQE), o êmbolo ao longo de todo o processo deve estar em equilíbrio. Ou seja, a força exercida pelo gás no êmbolo deve ter o mesmo módulo e sentido contrário da soma das forças exercidas sobre o êmbolo pelos agentes externos ao gás. Se apenas a mola se constituir em agente externo ao êmbolo, então é impossível de se realizar o processo de expansão muito lentamente!
Para que o processo muito vagaroso de expansão ocorra de fato, outro agente deve estar exercendo força no êmbolo além da mola. Este outro agente e a mola realizarão trabalho no êmbolo e portanto, o trabalho executado pelo gás no êmbolo somente em parte acarretará variações de energia potencial elástica na mola.
Quando o êmbolo finalmente atinge a posição em que a amostra gasosa duplicou de volume, a força elástica exercida pela mola poderá ou não ser igual em módulo à força exercida pelo gás no êmbolo pois o outro agente poderá ou não ainda estar exercendo força no êmbolo.
Na verdade a existência da mola para a solução do problema (bem como considerações sobre atrito no êmbolo) é irrelevante para a solução do problema. As únicas considerações relevantes para a solução do problema são:
1- A amostra gasosa realiza uma transformação quase-estática (vagarosa) durante a qual não troca calor. Portanto sofre um processo ADIABÁTICO REVERSÍVEL. Decorre então que as conhecidas expressões que relacionam volume e temperatura ou volume e pressão ou pressão e temperatura em ADIABÁTICAS REVERSÍVEIS podem ser utilizadas.
2 – A amostra gasosa duplicou de volume ao longo da transformação.
Daí sabendo-se que T.V^(gama -1) = constante, onde T é a temperatura, V é o volume e gama = 5/3 (gás monoatômico), a temperatura final é igual a temperatura inicial multiplicada por (2)^-0,6667 = 0,63. Vide GRÁFICOS DAS TRANSFORMAÇÕES GASOSAS ADIABÁTICAS
Desta forma o problema proposto somente tem solução se admitirmos a existência de um agente externo ao gás exercendo força no êmbolo ALÉM DA MOLA!
“Docendo discimus.” (Sêneca)
_________________________________
Comentários no Facebook
Alexandre C Tort – Essa rendeu uma discussão longa. Se os estados inicial e final são de equilíbrio, então é possível usar uma relação da forma TV^{gamma -1}=constante. A solução é a correta se a minha hipótese e a sua forem verdadeiras. A segunda solução viola a termodinâmica do equilíbrio e a primeira lei.
Fernando Lang da Silveira – Mas para que nossas respostas estejam corretas, já que o problema especifica que, não apenas as situações inicial e final sejam estados de equilíbrio, o processo é vagaroso (quase-estático; evoluindo em equilíbrio), deve existir uma ação extra mola sobre o êmbolo. Acho que os redatores da questão “escorregaram” pois a questão sugere fortemente (para não dizer que afirma!) que a única outra ação sobre o êmbolo seja a da mola.
Alexandre C Tort – Oi Fernando Lang da Silveira. O enunciado sugere que o êmbolo está acelerado, pois afirma que no ponto de equilíbrio a=0, o que me leva a concluir que antes a aceleração era diferente de zero. Mesmo que seja lento, o processo de expansão do gás não seria composto por uma sucessão de estados de equilíbrio. (E sendo a massa do êmbolo quase nula, um desequilíbrio de forças pode gerar uma aceleração apreciável). A solução 1 funciona se os estados inicial e final são de ET, como você já chamou a atenção, pois se esperarmos tempo suficiente o ET se estabelecerá. A ação extra deve também impedir que o êmbolo ultrapasse o ponto de equilíbrio.
Fernando Lang da Silveira – De fato o enunciado padece de muitos problemas de interpretação. Além disso, há redundância ao afirmar que na posição de equilíbrio a aceleração é nula. E como bem notaste na posição de equilíbrio a velocidade também deve ser nula e isto não está explicitado! Os idealizadores da questão “escorregaram” de fato! RIGOROSAMENTE ESTA QUESTÃO NÃO TEM SOLUÇÃO. Ou, para ter solução, suposições adicionais devem ser feitas.
_________________________________________________
Mais comentários no Facebook
Felipe G. Ben – Professor! Sobre essa questão, acredito que não seja necessário a suposição de que é um processo adiabático reversível. Se considerarmos apenas os estados inicial e final como estados de equilíbrio (processo irreversível), ainda assim nos estados inicial e final a relação PV = nRT é válida (embora, OK, as relações para processos adiabáticos reversíveis não sejam).
Teríamos então PoVo = RTo e P(2Vo) = RT (para os estados inicial e final, respectivamente).
Mesmo para o processo irreversível é válida a primeira lei da termodinâmica, que diz que deltaU = Q – W
Neste caso o gás não realiza trabalho contra uma atmosfera externa, de maneira que dW não é pdV, mas é certamente numericamente igual à energia potencial armazenada na mola.
Teríamos então Uo – U = kx²/2
Além disso, temos como condição de equilíbrio que a força feita pelo gás contra o êmbolo deve ser igual à força feita pela mola contra o êmbolo, isto é, F = kx = P*A.
Usando essas expressões é possível obter T = (6/7)To sem necessidade de tratar o processo como reversível.
Fernando Lang da Silveira – A condição de processo adiabático reversível está sugerida na frase: “O sistema está termicamente isolado e o êmbolo, inicialmente fixo, é então solto, deslocando-se VAGAROSAMENTE até passar pela posição de equilíbrio, em que a sua aceleração é nula e o volume ocupado pelo gás é o dobro original, conforme mostra a figura.”
Fernando Lang da Silveira – No processo que imaginas, como o sistema evolui fora do equilíbrio, ao atingir o ponto onde as forças se equilibram, deve existir também energia cinética macroscópica no êmbolo e no gás.
Fernando Lang da Silveira – Assim sendo, o estado de equilíbrio termodinâmico na posição de equilíbrio mecânico do êmbolo não deve ser atingido imediatamente quando êmbolo está pela primeira vez equilibrado.
Fernando Lang da Silveira – Como o enunciado sugere que a passagem do estado inicial para o final se dê de um só golpe, a solução que dás fica prejudicada. Entretanto concordo contigo que, dado que o problema é confuso de fato, esta solução por ti exposta é plausível.
Felipe G. Ben – Pois é, eu havia pensado em desprezar termos de energia cinética macroscópica em função do enunciado afirmar que a massa do êmbolo é desprezível, mas não saberia como levar em conta algum termo de energia cinética macroscópica do gás. Desprezando-se esses termos, essa abordagem me pareceu a “menos forçada”, mas admito que ainda assim algumas hipóteses adicionais têm que ser feitas, comprometendo a questão. Mas acho que isso também começa a levar para o lado de que é difícil refletir até que certo ponto uma questão de física consegue ser rigorosa em todos os aspectos. No fim acho que acaba indo para o mesmo lado de uma solução computacional numérica, sempre depende do grau de precisão que estaríamos dispostos a aceitar.
De qualquer maneira, muito obrigado pelos esclarecimentos!
Visualizações entre 27 de maio de 2013 e novembro de 2017: 4618.