Esfriando chá com movimento
11 de fevereiro, 2023 às 20:00 | Postado em Termologia, termodinâmica
Respondido por: Prof. Fernando Kokubun (FURG) - https://www.fisicaseteemeia.com.br/2021/Se agitarmos uma xícara com chá quente com uma colher, ela vai esfriar mais rapidamente, mas pela primeira lei da termodinâmica ao realizarmos trabalho no chá (com o movimento da colher), o chá deveria esquentar. Por que não esquenta?
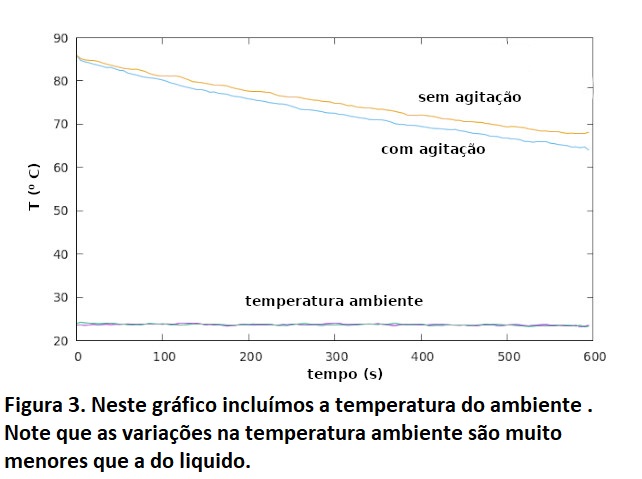
Antes de responder, o interessante é testar se de fato ocorre um resfriamento mais rápido ou não. Para tanto realizei medidas da variação da temperatura em um vidro Becker, com a água inicialmente em 86⁰C, sendo realizadas medidas por 10 minutos. Na figura 1 estão fotos ilustrativas do aparato experimental. Comparei a situação sem agitação e com agitação contínua. Devido a diferenças entre os sensores existentes no laboratório, optei por usar sempre o mesmo sensor para medir a temperatura na xícara. Como as medidas não foram realizadas simultaneamente, a temperatura do ambiente foi monitorada. Durante os experimentos as variações da temperatura ambiente não foram significativas, de forma que podemos considerar a temperatura ambiente constante em ambas as situações (com agitação e sem agitação).

Os resultados das medidas nas temperaturas com agitação e sem agitação estão apresentados nos gráficos da figura 2, onde fica claro que a variação da temperatura ocorre mais rapidamente com agitação do que sem agitação. A diferença final de temperatura comparando os casos com e sem agitação, foi cerca de 4⁰C (a precisão do sensor de acordo com o manual é de +/- 0,5 ⁰ C), sendo a temperatura mais baixa atingida com a agitação.
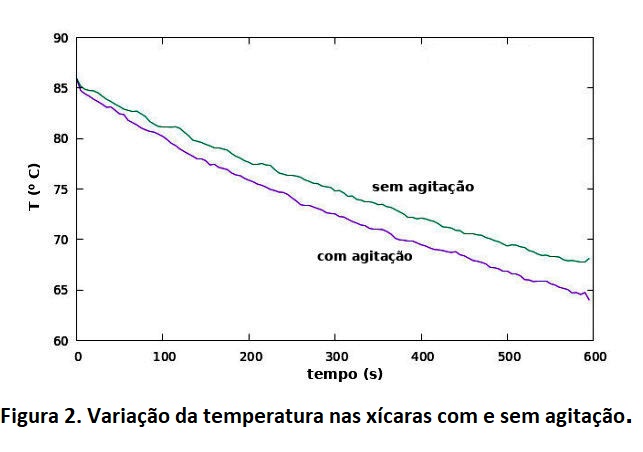
Mas como compatibilizar com a primeira lei da Termodinâmica, em especial com o experimento de Joule? (Veja por exemplo em Energia Mecânica e Calor). Entendendo quais os processos envolvidos em cada caso! Não fixar apenas na agitação do sistema. (Um caso interessante de que a agitação ajuda a esfriar está relatado em Resfriando Rapidamente a Cerveja?, ressaltando que a parte que esfria é a cerveja.) No caso do experimento de Joule, o sistema a ser aquecido com agitação deve estar isolado do ambiente (a única entrada é a da energia externa no sistema, mas idealmente não sai energia do sistema), de forma que toda energia que é fornecida ao sistema e que vem de fora, é mantida no sistema. Neste caso a energia interna do sistema aumenta, mas note que não estamos CRIANDO energia, pois o excesso vem de uma fonte externa. Aqui uma ressalva importante, se o sistema for por exemplo água e gelo em equilíbrio, a energia externa não vai aumentar a temperatura, mas acelerar a mudança de fase. Isto é, o aumento da energia interna nem sempre implica no aumento da temperatura.
No caso da xícara, o sistema não é fechado, ocorrendo uma troca de energia com o ambiente. Esta troca ocorre através da superfície de contato do líquido com o ambiente e se a xícara for um bom isolante térmico, vai ocorrer principalmente na superfície livre do líquido com o ambiente, caso contrário com toda superfície de contato do liquido, incluindo a que está em contato com a xícara.
Ao agitarmos o líquido, ocorre uma transferência da energia mecânica para o líquido, mas a agitação faz com que diferentes partes do líquido entre em contato com o ambiente. Em líquido sem agitação, inicialmente é o líquido na superfície superior que esfria (e dependendo do material da xícara, a parte em contato com a xícara esfria significativamente), e só depois as camadas mais internas. O esfriamento das camadas internas pode ocorrer ou por condução de calor ou por convecção, dependendo das condições do sistema. Com a agitação, misturamos as diferentes camadas e colocamos as camadas mais quentes internas em contato com o ambiente (mais frio) de forma mais rápida do que ocorreria sem a agitação. Esta troca de energia com o ambiente é muito mais rápida do que a rapidez com qual energia é fornecida ao sistema com a agitação (que é um processo ineficiente para aumentar a temperatura do sistema), de forma que o resultado final é o sistema (nosso chá) perder energia para o ambiente de forma mais rápida com a agitação do que sem a agitação.
Um outro fator que ajuda a resfriar, é com a utilização de uma colher metálica. Por ser um bom condutor térmico, o metal da colher ajuda na troca pelo processo de calor com o ambiente, e quanto maior a área da colher, melhor este processo.

Muito interessante esse fenômeno por ser contraintuitivo. Eu acrescentaria o fato de que, no líquido agitado, a superfície de contato com o ambiente, por onde há a troca de calor, é maior que no caso sem agitação. Não sei o quanto isso seria significativo, mas, pela foto, parece que a deformação da superfície livre é grande.
Prof. ouço muitas pessoas dizerem isso, que manter a colher dentro do café ajuda a esfriar mais rapidamente, mas tenho as seguintes dúvidas: esse efeito seria significativo, comparado a perda de energia por convecção? Como eu poderia fazer uma estimativa quantitativa comparando essas duas perdas?
Vai depender da área de contato com o líquido e com o ar. Mas é um.processo que não é muito eficiente.