Quando de fato uma amostra gasosa pode ser tratada como um Gás Ideal?
29 de setembro, 2015 às 9:18 | Postado em Estrutura da matéria, Gás e vapor, Teoria Cinética dos Gases, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Por que o Nitrogênio é uma boa escolha para o estudo do comportamento dos gases ideais próximo da temperatura ambiente?
O modelo de Gás Ideal funciona razoavelmente para um gás real acima da sua TEMPERATURA CRÍTICA (TC) e quando a densidade do gás é muito menor do que sua densidade na fase líquida. Lembremos que acima da TC, por mais que se aumente a pressão a substância gasosa não pode ser liquefeita. Um pouco mais sobre a TC vide por exemplo Armazenando metano em botijões de gás de cozinha.
Ora, a TC do nitrogênio é 126 K e a PRESSÃO CRÍTICA é cerca de 34 atm. O PONTO CRÍTICO de muitas substâncias pode ser encontrado em Critical_point_(thermodynamics).
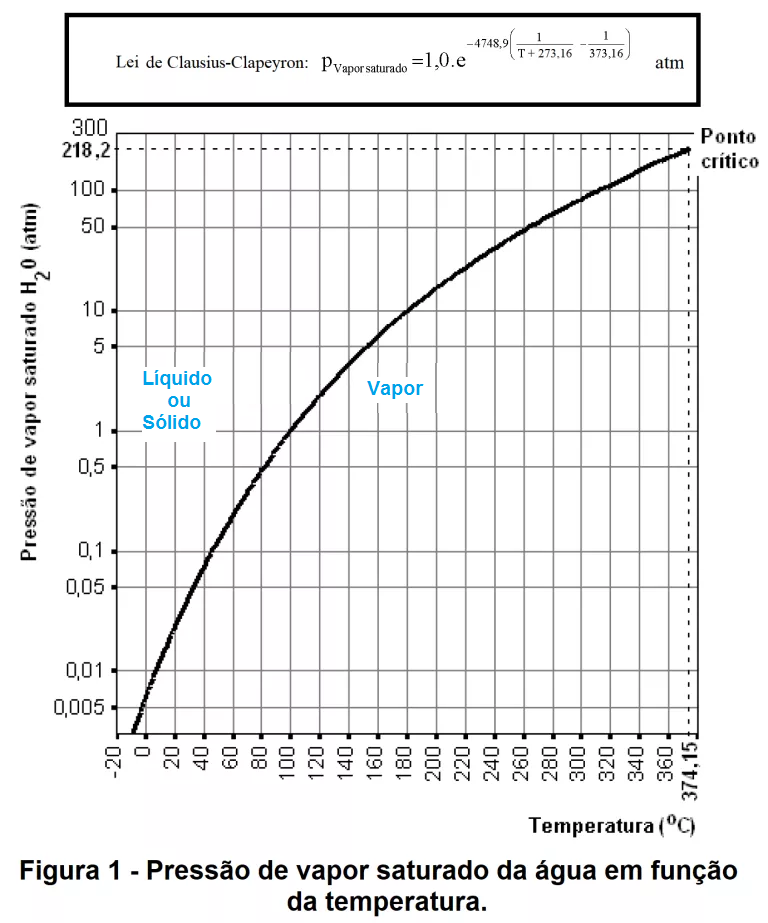
Adicionalmente o modelo de Gás Ideal é aplicável aproximadamente para vapores (portanto abaixo da TC da substância) desde que a pressão parcial do vapor seja muito menor do que a sua PRESSÃO DE VAPOR SATURADO (PVS) naquela temperatura. A PVS é dada pela Lei de Clausius-Clapeyron.
Postagens que tratam da Lei de Clausius-Clapeyron: Clausius-Clapeyron.
“Docendo discimus.” (Sêneca)
Visualizações entre 27 de maio de 2013 e novembro de 2017: 746.
