Propriedades da água
3 de março, 2015 às 18:53 | Postado em Estrutura da matéria
Respondido por: Profa. Marcia Barbosa - IF-UFRGSProfessora Marcia Barbosa
Li reportagens, trabalhos de tua autoria na internet, em revistas, publicações – nacionais e internacionais – e resolvi te escrever. Sou autodidata. Quem sabe possas me auxiliar. Tais questionamentos nada mais são do que meras curiosidades que tenho. Gostaria de saber…
A quinze graus Celsius, o calor específico da água é mínimo. Por quê? Como é que se mede, como é que se calcula o calor específico da água?
Não é fácil não a água passar do estado liquido para o estado gasoso; nem do estado gasoso para o estado sólido, tampouco do estado sólido para o estado líquido. Por quê?
A água atinge sua temperatura máxima aos três vírgula noventa e oito graus Celsius. Por quê?
A união entre o átomo de oxigênio com os átomos de hidrogênio para originar a molécula de água libera grande quantidade de energia. Por quê?
Como efeitos quânticos elucidam excentricidades na molécula de água?
Responda quando puder por gentileza.
A quinze graus Celsius, o calor específico da água é mínimo. Por quê? Como é que se mede, como é que se calcula o calor específico da água?
O mínimo do calor especifico a pressão constante igual a 1 atm ocorre a 36º C e não 15º C. Calor especifico é a quantidade de calor necessária para aumentar em 1º C a temperatura de 1 g da substância. Para materiais com padrão “normal” o calor específico aumenta com a temperatura.
Para a água isto é verdade para temperaturas superiores a 36º C conforme representa o gráfico que segue.
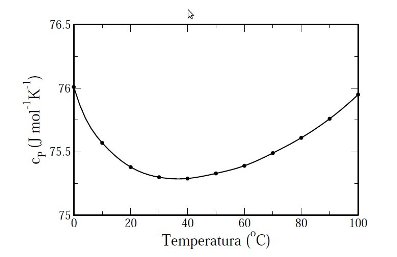
Por que é assim? A teoria mais popular é que a água a temperaturas muito baixas forma duas fases liquidas e que o aumento do calor específico viria da aproximação da temperatura crítica destas fases. Indico o seguinte vídeo: http://education-portal.com/academy/lesson/how-to-calculate-specific-heat-capacity-for-different-substances.html
Não é fácil não a água passar do estado liquido para o estado gasoso; nem do estado gasoso para o estado sólido, tampouco do estado sólido para o estado líquido. Por quê?
A água forma ligações de hidrogênio. E difícil quebrar estas ligações e estas ligações são responsáveis pelo ordenamento da água.
Para fundir devemos dar muito calor para quebrar as ligações. Para passar de liquido para gás ainda mais calor para destruir totalmente as ligações.
A água atinge sua temperatura máxima aos três vírgula noventa e oito graus Celsius. Por quê?
A água não atinge temperatura máxima, mas densidade máxima a 3,98º C e a 1atm. Este valor muda ao mudar a pressão. Para líquidos “normais” ao aumentar a temperatura diminui a densidade. Aumentando a temperatura aumenta a desordem, mais as partículas ficam longe uma das outras. Isto é verdade para a água ate 3,98º C. Abaixo disto as ligações começam a dominar e para formar ligações é preciso espaço e para formar o espaço as moléculas se afastam, aumentando o volume, diminuindo a densidade. Veja gráfico em que segue.
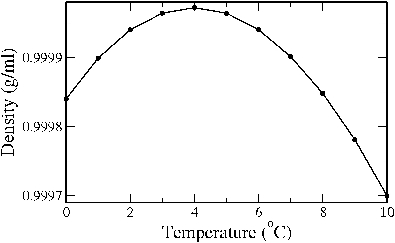
A união entre o átomo de oxigênio com os átomos de hidrogênio para originar a molécula de água libera grande quantidade de energia. Por quê?
Toda a formação de moléculas libera energia. Isto é verdade para água e outros materiais.
Como efeitos quânticos elucidam excentricidades na molécula de água?
As anomalias vem de outro efeito quântico que são as ligações de hidrogênio. Vide https://www.youtube.com/watch?v=lkl5cbfqFRM
Outras questões do CREF sobre água e as suas propriedades:
- A informação de que o gelo flutua em água líquida permite concluir como a temperatura de fusão do gelo varia com a pressão exercida?
- Superaquecimento no forno de microondas!
- E se o experimento de Torricelli para medir a pressão atmosférica fosse feito com água ao invés de mercúrio?
- Abastecimento de água no inverno quando a temperatura é muito baixa
- Umidade relativa: o que é e como se determina?
- Curvas reais de aquecimento da água
- Garrafa pet na braseiro não derrete e água ferve!
- Evaporação de água no solo??
- Pressão de evaporação da água?
- Confusão recorrente sobre vaporização da água
- Desembaçando o vidro com ar frio
- O que acontece se alguém jogar um copo de água no vácuo do espaço?
- Como se apresenta a água a -5 ºC a pressão normal?
- É possível armazenar vapor de água em um cilindro?
- Por que durante o processo de esterilização, os instrumentos são submetidos a temperaturas elevadas?
- Fabricando neve no Youtube!?
- Termodinâmica: vaporização da água
- Fragmentação de rochas que contém água em suas rachaduras
- Podemos esterilizar alicate de cutícula na panela de pressão?
- Onde se cozinha mais rápido, em BH ou La Paz?
- Pressão na panela
- Fusão do gelo: como proceder para manter o gelo por mais tempo?
- Congelamento dos lagos
Visualizações entre 27 de maio de 2013 e novembro de 2017: 2240.
