Pressão máxima em um recipiente com nitrogênio líquido
27 de junho, 2017 às 9:56 | Postado em Gás e vapor, Teoria Cinética dos Gases, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Professor Lang
No vídeo Experiencia cientifica com nitrogênio liquido e 1500 bolinhas de ping-pong uma garrafa pet contendo nitrogênio líquido explode e lança bolinhas de ping-pong. Existe uma forma de se estimar a temperatura do nitrogênio em que ocorre a explosão? Caso a garrafa suportasse uma pressão muito grande e não explodisse, como se calcula a pressão na garrafa? Agradeço antecipadamente sua resposta, aproveitando para parabenizar a sua instituição pela iniciativa em manter um site como este.
É possível estimar a temperatura em que ocorre a explosão a partir da pressão máxima que uma garrafa pet suporta. Uma pesquisa na internet leva a que a pressão para explodir uma garrafa pet tem valor entre 150 psi a 200 psi. Portanto admitirei para fins de cálculo que a garrafa suporte até 200 psi ou cerca de 14 atm.
A pressão de vapor saturado do nitrogênio líquido está fornecida em https://encyclopedia.airliquide.com/nitrogen. Construi então o gráfico seguinte que fornece a pressão de vapor saturado em função da temperatura.
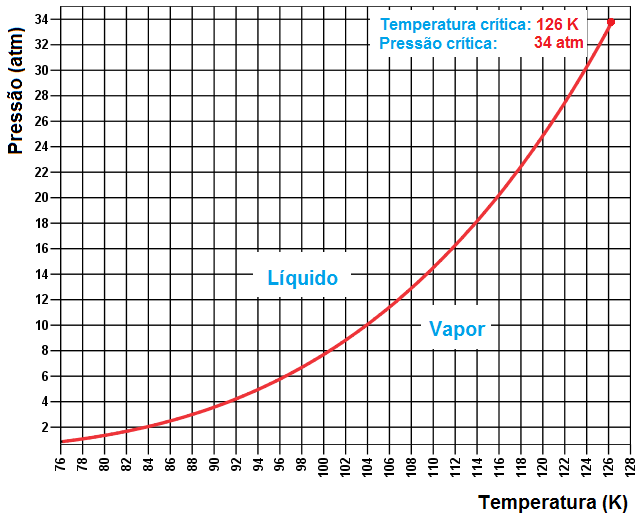
O nitrogênio liquido encontra-se inicialmente a pressão de 1 atm e, portanto, segundo a curva fornecida no gráfico acima, está a 78 K no início do experimento, quando a garrafa pet é lacrada e jogada para dentro de um latão com as bolinhas de ping-pong por cima. A pressão dentro da garrafa, onde coexistem as fases líquida e gasosa (vapor), então se eleva conforme a temperatura no interior da garrafa cresce e este crescimento é regido pela Lei da Clausius-Clapeyron representada pela linha vermelha no gráfico. Supondo que a explosão ocorra quando a pressão atinge 14 atm, estima-se a tempertura em cerca de 110 K.
A linha vermelha que descreve o comportamento da pressão de vapor saturado acaba no ponto crítico, isto é, a 126 K e 34 atm. Acima da temperatura de 126 K não mais é possível, por mais que se aumente a pressão, liquefazer o nitrogênio. Ou seja, em temperaturas superiores a 126 K a fase gasosa não é mais VAPOR, sendo então denominada da GÁS.
Caso a garrafa suporte pressões suficientemente altas, a temperatura interna à garrafa será finalmente a temperatura do ambiente que, para fins de cálculo, admitirei ser 293 K ou 20 graus célsius.
Para temperaturas superiores à temperatura crítica, dado que a densidade do gás é elevada no interior da garrafa, a conhecida Equação Geral de Estado para um Gás Ideal não pode ser utilizada. Uma melhor aproximação para gases densos em pressões altas é a Equação de Estado de van der Waals dada abaixo, onde P, V, T e n são as bem conhecidas variáveis de estado (pressão,volume, temperatura, número de mols) e os parâmetros “a” e “b” são as chamadas constantes de van der Waals que dependem da susbstância (neste caso nitrogênio).
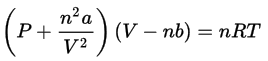
Vou supor que o volume da garrafa seja de V = 1 L e que ele não se modifique enquanto a temperatura se eleva até 293 K. Dá para notar no vídeo que cerca de 1/3 do volume inicial era nitrogênio na fase líquida, portanto inicialmente havia cerca de 0,33 L de nitrogênio líquido. A densidade do nitrogênio líquido a 1 atm é cerca de 0,80 kg/L, o que significa que inicialmente a massa na garrafa é 0,264 kg. A massa molar do nitrogênio é 0,028 kg e portanto o número de mols na garrafa é n = 9,4 mol. Os valores das contantes são a = 1,37 L2.atm/mol2 e b = 0,0387 L/mol.
Calculando a pressão na temperatura ambiente encontra-se 236 atm. Um pressão com tal valor pode ser suportada por um tanque de aço do tipo daqueles utilizados em reservatórios de GNV de veículos automotores (a estocagem em tais tanques é feita em pressões de cerca de 200 atm).
Outras postagens sobre temas correlatos:
Aumento de temperatura em um botijão com metano líquido
Armazenando metano em botijões de gás de cozinha
Armazenando GNV em botijão de butano: RISCO DE EXPLOSÃO!
Compressão, estoque e utilização de metano
“Docendo discimus.” (Sêneca)
Visualizações entre 27 de maio de 2013 e novembro de 2017: 954.
