Os átomos na molécula de água se separam acima da temperatura crítica?
10 de maio, 2017 às 11:06 | Postado em Gás e vapor, Mudanças de estado da matéria, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Professor Lang, no diagrama de fases da água, temos aquela região que já não mais representa o vapor de água e sim a substância como um gás. Quero saber se quando ela vira gás (acima da temperatura crítica) ela continua como sendo H20, ou se os átomos se separam? Obrigada
Muitas substâncias gasosas no nosso cotidiano se encontram acima da temperatura crítica e portanto são GASES de fato e não VAPORES. É o caso do oxigênio, do nitrogênio, do hidrogênio, do hélio, do metano. … . Todas estas substâncias tem temperatura crítica bem abaixo da temperatura ambiente mesmo em regiões muito frias. Assim sendo estas substâncias NÃO podem se liquefeitas por simples aumento da pressão, por mais que se aumente a pressão. Vide por exemplo Armazenando metano em botijões de gás de cozinha
Outras substâncias gasosas são no nosso cotidiano VAPORES pois suas temperaturas críticas se encontram acima da temperatura ambiente mesmo em regiões muito quentes. É o caso da água, do propano, do butano, … Tais substâncias podem ser liquefeitas na temperatura ambiente desde que a pressão seja suficientemente alta (igual ou maior do que a pressão de vapor saturado da substância na temperatura em que se encontra). Vide A pressão é diferente em um botijão de gás de 13 kg e 45 kg?
Pontos críticos (pressão e temperatura crítica) de diversas substâncias são encontras em https://en.wikipedia.org/wiki/Critical_point_(thermodynamics).
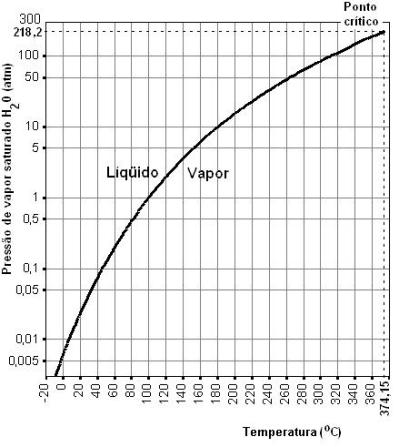
A temperatura crítica da água é 374°C. Acima dessa temperatura a água não pode ser liquefeita por mais que se aumente a pressão. E se é água então os átomos das moléculas estão ligados pois se não estivessem ligados a substância passaria a ser uma mistura de hidrogênio com oxigênio, não tendo mais sentido se falar em água. Ou seja, abaixo da linha contínua no gráfico (curva da pressão de vapor saturado da água dada pela Lei de Clausius_Clapeyron) que segue encontramos a água como VAPOR e a direita, além da linha pontilhada que corresponde à temperatura crítica, a água é GÁS. Vide também Como calcular a pressão na panela de pressão conhecida a temperatura?
No Polo Petroquímico próximo a Porto Alegre existe uma usina de geração de energia elétrica que opera com água como substância de trabalho nas turbinas de geração. A primeira turbina pela qual a substância de trabalho passa recebe GÁS de água que na sua saída já é VAPOR.
Finalmente, se a temperatura do gás de água estiver muito elevada (cerca de 2200°C) começa a ocorrer a quebra das ligações entre os átomos (vide Termólise da água) separando-se o oxigênio do hidrogênio. Entretanto tal efeito não está contemplado nos diagramas de fase que usualmente aparecem em textos de Termodinâmica elementar.
Vide também Um_tema_negligenciado_em_textos_de_Física_Geral:_a_vaporização_da_água
“Docendo discimus.” (Sêneca)
Visualizações entre 27 de maio de 2013 e novembro de 2017: 1236.

Existe continuação para o gráfico mostrado acima?
Tenho interesse na possibilidade de alcançar temperaturas entre 500 e 600°C para água,
Contudo pressão se faz muito importante nesta temperatura.
Grato
Acima da temperatura crítica a curva representada no gráfico não continua pois ela representa as condições de temperatura e pressão em que as fases líquida e de vapor coexistem. Acima da temperatura crítica a fase liquida é impossível e a água é então um gás.
Boa tarde!
A partir de qual temperatua a molécula de água é quebrada, ou seja, acontece a separação do Hidrogênio e Oxigênio?
Na temperatura de 3000°C mais da metade das moléculas de água se decompuseram. Vide Wikipedia.
Se eu tentar usar agua para apagar um fogo com elevada tempertura pode ocorrer decomposição da agua em H2 e O2 e isso piorar a situação? Já que neste caso a agua agiria como um combustível.
Mesmo que pudesse acontecer a decomposição, a energia liberada pela queima do hidrogênio não compensaria o resfriamento já acontecido na etapa anterior.
Alguém pode me fala se o hidrogênio e oxigênio voltam a se unir e se isso acontece, é por que eu tenho a impressão que ao chegar na ionosfera isso ocorre com efeito da aurora borial, e se minhas suspeitas estão certas.
A combinação do hidrogênio com oxigênio nada tem a ver com a aurora boreal.
Quando tentamos interromper a queima de limalhas de magnésio, usando água, ocorre explosões e um aumento no volume das chamas, creio que é devido a queima do hidrogêndio e/ou do oxigênio alimentanco mais a combustão. Lembrando que o magnésio queima em altas temperaturas….Esta correto o raciocinio?
O magnésio é capaz de reduzir a água ao gás hidrogênio altamente inflamável. Este gás entra em combustão devido à grande elevação da temperatura propiciada pela reação exotérmica de redução.