É possível armazenar vapor de água em um cilindro?
4 de março, 2013 às 21:13 | Postado em Gás e vapor, Mudanças de estado da matéria, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Suponha que eu aqueça a água, e de alguma maneira eu faça uma ligação entre o recipiente que a água esta sendo aquecida e um cilindro (por exemplo: tipo um botijão de gás vazio, por exemplo), ou seja, o vapor vai enchendo o cilindro. Ao retirar e lacrar o cilindro o que acontecera com o vapor ? ele virará água dentro do cilindro ? (porque a temperatura do cilindro é menor) ou ficará definitivamente no estado de vapor ? (ao passo que ao abrir o cilindro saia vapor e não água) ?
Pergunta originalmente feita em http://br.answers.yahoo.com/question/
Comentário do autor da pergunta após a resposta abaixo:
Resposta completa, com informações objetivas
Inicialmente uma consideração importante:
Vapor de água pode existir não apenas acima dos 100 graus Célsius mas em qualquer temperatura. O ar que respiramos contem vapor de água em maior ou menor quantidade, dependendo da umidade relativa e da temperatura ambiente. O importante dessa consideração inicial é que água líquida e vapor de água podem existir simultaneamente no mesmo ambiente.
Responderei tua questão imaginando um recipiente inicialmente evacuado, no qual introduzimos vapor de água lentamente. A introdução inicial de vapor no recipiente, mantida a sua temperatura constante, elevará a pressão. Entretanto se a introdução de vapor for continuada, a pressão continuará aumentando mas finalmente será atingida a PRESSÃO DE VAPOR SATURADO (PVS). Então introdução de mais vapor no recipiente NÃO mais aumentará a pressão, ocasionando a liquefação do vapor excedente. Ou seja, não se pode ter vapor de água em pressões superiores a sua PVS.
A PVS é dependente da temperatura. Exemplificando:
Para a temperatura é 20º C a PVS é 0,02 atm.
Para a temperatura é 100º C a PVS é 1 atm.
Para a temperatura é 140º C a PVS é 5 atm.
Para a temperatura 180º C a PVS é cerca de 10 atm.
Para a temperatura 200º C a PVS é cerca de 15 atm.
Para a temperatura 260º C a PVS é cerca de 50 atm.
Para a temperatura 300º C a PVS cerca de 85 atm.
Este crescimento acentuado da PVS com a temperatura é regido pela “Lei de Clausius-Clapeyron” que está dada na figura abaixo.
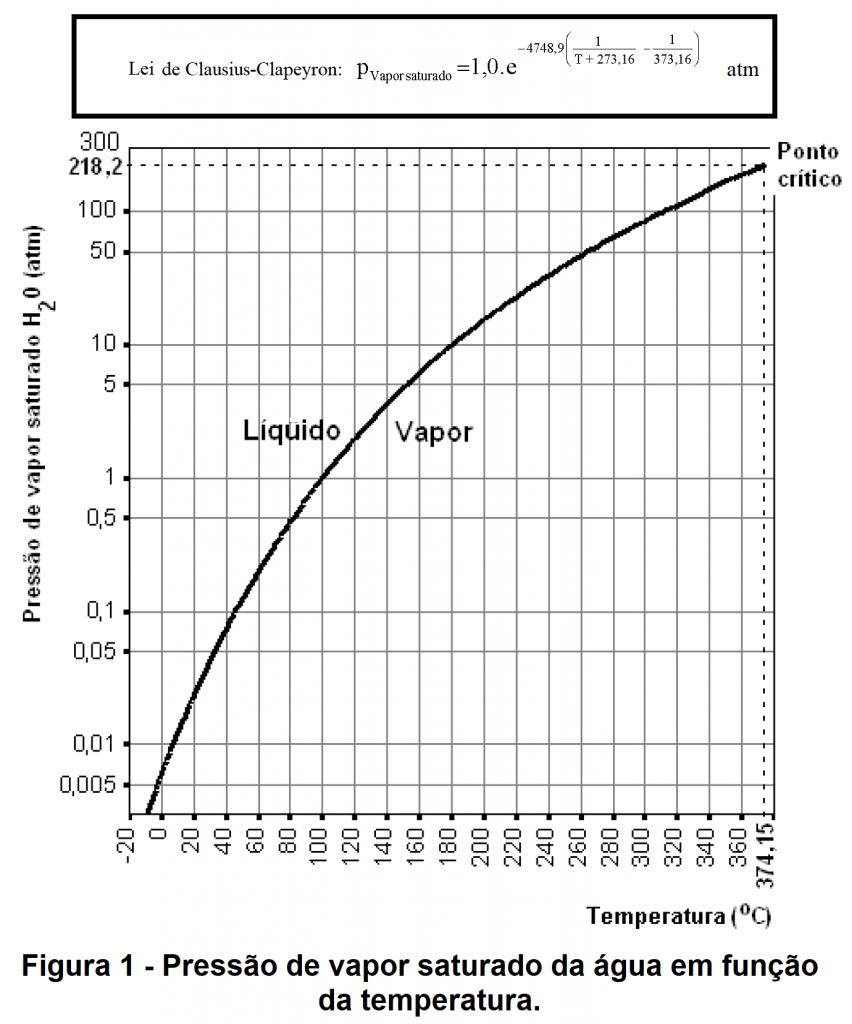
Portanto existir vapor de água a 10 atm (pressão compatível com a pressão em um botijão de gás) deve-se manter o botijão em temperatura igual ou superior a 180º C. E se a temperatura não for mantida constante, a pressão decrescerá rapidamente com o abaixamento da temperatura pois conforme diminui a temperatura parte do vapor se liquefaz. Finalmente, na temperatura ambiente de 20º C restará muito pouco vapor no interior do recipiente.
Veja outras perguntas e respostas que tem relação com este tema:
Como aumentar a temperatura da panela de pressão sem correr o risco de ela explodir?
Armazenando metano em botijões de gás de cozinha
Umidade relativa: o que é e como se determina?
“Docendo discimus.” (Sêneca)
Visualizações entre 27 de maio de 2013 e novembro de 2017: 2546.
