Calor latente de sublimação
30 de setembro, 2024 às 14:23 | Postado em Estrutura da matéria, Gás e vapor, Mudanças de estado da matéria
Respondido por: Prof. Fernando Lang da Silveira - IF-UFRGSPrimeiramente parabéns pelo trabalho! Gostaria de saber se faz algum sentido definirmos o calor latente de sublimação. Se sim, seria possível dizer que esse calor latente de sublimação pode ser calculado como sendo a soma do calor latente de fusão com o calor de vaporização? Obrigado pela atenção desde já!
Sim, é possível desde que se tome um cuidado importante pois o calor de vaporização (entalpia de vaporização) de um substância geralmente varia com a temperatura. Ou seja, somente é uma constante em uma específica temperatura.
Daqui em diante a resposta será contextualizada tomando-se a água como exemplo.
O conhecido valor de 540 cal/g (ou 2260 kJ/kg) para o calor latente de vaporização (entalpia de vaporização) é válido para 100°C. Para a água líquida a 0°C a entalpia de vaporização vale 597 cal/g (ou 2500 kJ/kg segundo a Wikipedia).
É importante notar que em qualquer temperatura a água pode passar para o estado de vapor e não apenas a 100°C (temperatura de ebulição na pressão 1 atm). E quando ocorre a transformação de líquido em vapor o calor de vaporização, na temperatura em que o processo acontece, é importante.
Da mesma forma a entalpia de sublimação (calor de sublimação) de uma substância depende da temperatura. Segundo a Wikipedia a entalpia de sublimação da água sólida a 0°C é 2834 kJ/kg (ou 667 cal/g).
O gráfico da figura 1 representa o calor de sublimação/vaporização da água em função da temperatura. O gráfico foi construído a partir dos dados encontrados em [1], [2] e [3] para a faixa de 100K até 375K.
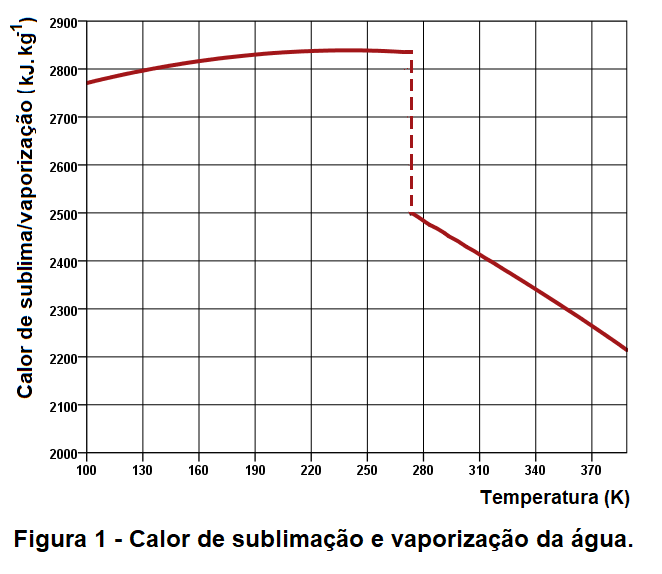
O gráfico da figura 1, além de mostrar que o calor de sublimação/vaporização varia com a temperatura, apresenta uma descontinuidade em 273K (0°C) que que corresponde à fusão/solidificação da água. O valor da descontinuidade (334 kJ/kg ou 80 cal/g) é calor de latente de fusão.
Portanto, apenas nessa temperatura é que “calor latente de sublimação pode ser calculado como sendo a soma do calor latente de fusão com o calor de vaporização“.
O gráfico da figura 2 representa o calor de sublimação/vaporização da água em função da temperatura para a faixa de 10K até 647K (374°C).
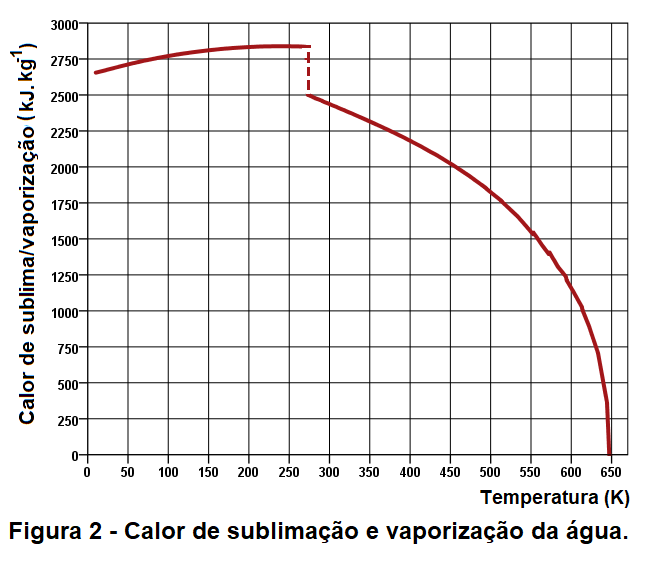
O gráfico de figura 2 indica que o calor de vaporização da água se anula 674K, temperatura crítica da água. A temperatura crítica de uma substância é a temperatura na qual e acima da qual o estado gasoso da substância não pode ser liquefeito, não importa quanta pressão seja aplicada.
Postagens relacionadas com esta:
REFERÊNCIAS
[1] – The Engineering Tool Box – Water properties
[2] – Wikipedia – Water (data)
[3] – Rainer Feistel, Wolfgang Wagner, Sublimation pressure and sublimation enthalpy of H2O ice Ih between 0 and 273.16K, Geochimica et Cosmochimica Acta, V.71, I. 1, 2007, 36-45, ISSN 0016-7037, https://doi.org/10.1016/j.gca.2006.08.034.
“Docendo discimus.” (Sêneca)

Boa tarde professor.
Imagine que temos chuveiro que mantém a temperatura à 42ºC. Como posso estimar a taxa (fluxo) de água convertida em vapor (gramas/seg)?
Talvez a equação 1 de UM CICLO DE MODELAGEM SOBRE A LEI DE RESFRIAMENTO DE NEWTON te auxilie.