Dúvida sobre expansão livre
16 de outubro, 2025 às 16:58 | Postado em Gás e vapor, Teoria Cinética dos Gases, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - IF-UFRGSProfessor
Se em uma expansão livre de um gás ideal a temperatura inicial é igual a final, por que esta transformação não é isotérmica? E por que o gás não realiza trabalho se ele aumenta de volume?
Em uma expansão livre o gás escapa de um compartimento pressurizado para um compartimento evacuado e ambos compartimentos possuem paredes rígidas e adiabáticas.
Para que exista realização de trabalho pelo gás alguma coisa – um sistema material – deve estar recebendo este trabalho. Contra o vácuo não há possibilidade do gás realizar trabalho.
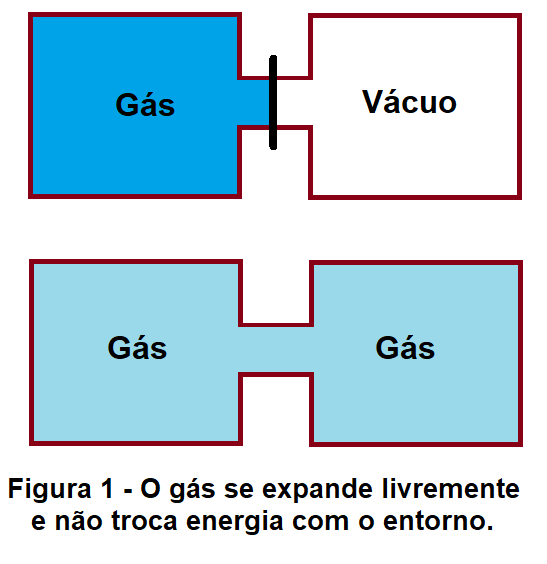
Para que uma transformação seja isotérmica, durante toda a transformação a temperatura deve estar definida e ser constante. Uma expansão isotérmica é um processo reversível, muito lento (quase-estático) em que o gás cresce de volume, trocando energia com o entorno por intermédio dos processos denominados como trabalho e calor.
Uma expansão livre é um processo irreversível durante o qual as variáveis de estado não estão definidas. Ou seja, não é que a temperatura (e as demais variáveis de estado como a pressão e o volume) varie, ela não existe durante o processo, não é possível durante o processo se estabelecer uma temperatura. No final da expansão livre (assim como antes de ela acontecer), quando o sistema gasoso se encontra novamente em equilíbrio, as variáveis de estado estão definidas. E como o gás não trocou energia com o entorno, seja pelo processo de trabalho, seja pelo processo de calor, a sua energia interna permaneceu inalterada e quando finalmente o gás estiver em equilíbrio, a sua temperatura estará definida e igual à temperatura antes da expansão.
Vide também postagem Entropia na expansão livre e na expansão adiabática.
Aqui um vídeo sobre o tema: Expansão livre
“Docendo discimus.” (Sêneca)
