Curva de pressão de vapor saturado do butano
15 de dezembro, 2023 às 13:13 | Postado em Gás e vapor, Termologia, termodinâmica
Respondido por: Prof. Fernando Lang da Silveira - www.if.ufrgs.br/~lang/Boa tarde!
Gostaria de ter acesso a curva de pressão de vapor saturado de butano com a representação de estados físicos (líquido/gasoso) segundo a equação de Clausius-Clapeyron.
Desde já agradeço!
Esta postagem é complementada pelo documento Pressão de vapor saturado do butano em função da temperatura disponível no Research Gate.
A Equação de Clausius-Clapeyron é uma função que descreve de maneira aproximada a relação da pressão de vapor saturado (pvs) de uma substância com a temperatura [1]. Genericamente esta equação pode ser escrita como
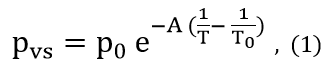
onde A e p0 são parâmetros a serem determinados a partir dos valores que constam na tabela da seção 1 de Pressão de vapor saturado … . A temperatura T0 é arbitrariamente escolhida e a ela corresponde p0.
Os dados de pvs em função da temperatura se encontram na seção 1 de Pressão de vapor saturado … . O Método dos Mínimos Quadrados foi utilizado para a determinação dos parâmetros A e p0, escolhendo-se T0 =293K (aproximadamente 20°C). Os parâmetros encontrados foram A=2798kelvin e p0=2,01bar. O coeficiente de determinação para função ajustada resultou em R2=0,9999; portanto o ajuste da Equação de Clausius-Clapeyron aos dados da tabela 1 foi quase perfeito.
Desta forma a Equação de Clausius-Clapeyron para o butano é
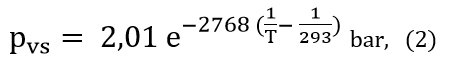
onde T é a temperatura absoluta em kelvin. Esta equação é válida para temperatura igual ou inferior à temperatura crítica do butano que é 152°C; a pressão crítica do butano é 32bar. Como é bem sabido acima da temperatura crítica a substância não se liquefaz por mais que se aumente a pressão.
A figura 1 é o gráfico pressão de vapor saturado em função da temperatura (em °C). Os pontos vermelhos representam os valores que constam na seção 1 de Pressão de vapor saturado … ; a linha azul representa os valores ajustados pela Equação de Clausius-Clapeyron (equação 2).
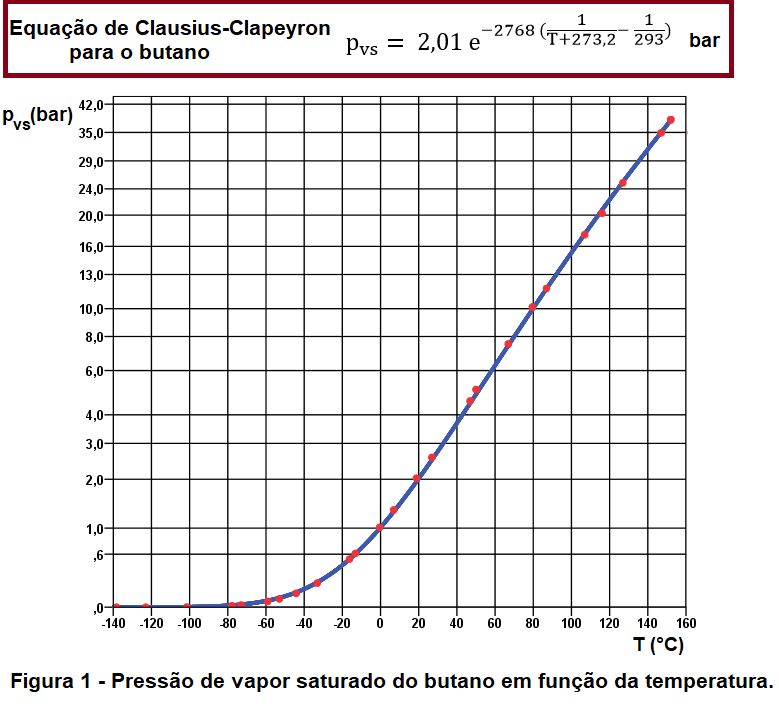
A curva de pressão de vapor saturado separa a fase líquida do butano (quando então a pressão é maior do que a pvs) da fase gasosa ou vapor (quando então a pressão é menor do que a pvs). Exatamente sobre curva azul as duas fases convivem em equilíbrio.
O gráfico da figura 2 apresenta a curva de pvs do butano em uma faixa mais estreita de temperatura.
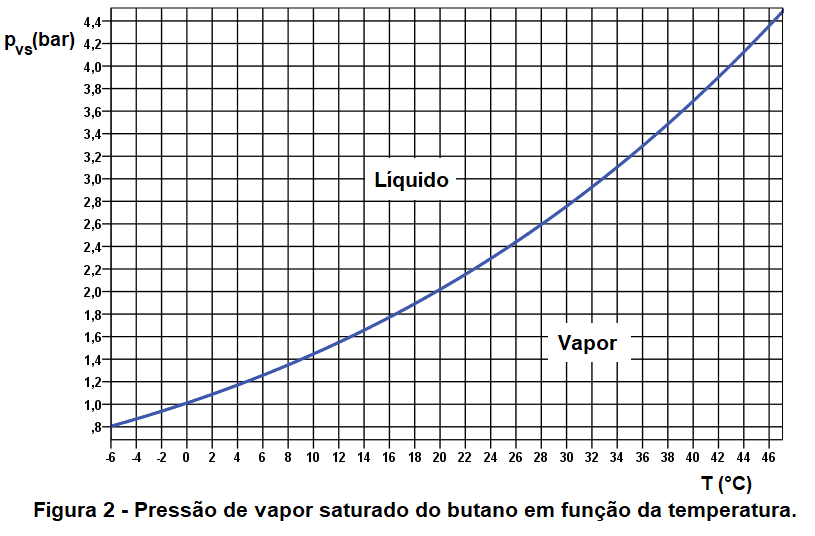
É interessante notar que na temperatura de 0°C a pvs do butano é praticamente igual à pressão atmosférica normal. Para que o vapor de butano saia do botijão ou botija no qual está armazenado a pressão interna (que é a própria pvs) deve ser maior do que a pressão externa. Desta forma o botijão para de funcionar em temperaturas próximas de 0°C.
REFERÊNCIA
[1]- Ott, J. B. e Boerio-Goates, J. Chemical Thermodynamics: Principles and Applications . Academic Press, 2000.
“Docendo discimus.” (Sêneca)
